基因疗法公司芳拓生物港股递表,今年前九个月亏损1330万美元
12月23日,Frontera Therapeutics(中文名称:芳拓生物)递表港交所,瑞银集团、国泰海通担任联席保荐人。
招股书显示,芳拓生物成立于2019年,专注于自主开发创新的重组腺相关病毒(rAAV)基因疗法、目前,公司产品管线包括8款自主开发的rAAV基因治疗候选药物。如果顺利上市,芳拓生物或有望成为“AAV基因治疗第一股”。

芳拓生物产品管线
AAV作为一种复制缺陷型病毒的发现可追溯至1965年,基因治疗的概念于1971年提出,而rAAV于1974年首次被用作基因递送载体。FDA于1990年批准全球首项基因治疗人体临床试验。2017年,Luxturna成为首款获FDA批准的rAAV基因疗法。2022年以来,受底层技术的成熟及更完善的监管框架所推动,基因治疗药物的批准率大幅加快。
FT-002是芳拓生物的核心管线之一,这是一种正在研究用于治疗X连锁视网膜色素变性(XLRP)的潜在全球同类最佳候选药物。FT-003是一款潜在全球同类最佳候选药物,正在研究用于透过玻璃体内注射治疗新生血管性老年性黄斑病变(nAMD)及糖尿病黄斑水肿(DME)。招股书显示,两款药物在中国的二期临床招募完成,其中FT-003的nAMD适应证于2026年第三季度前开始中国三期临床试验。
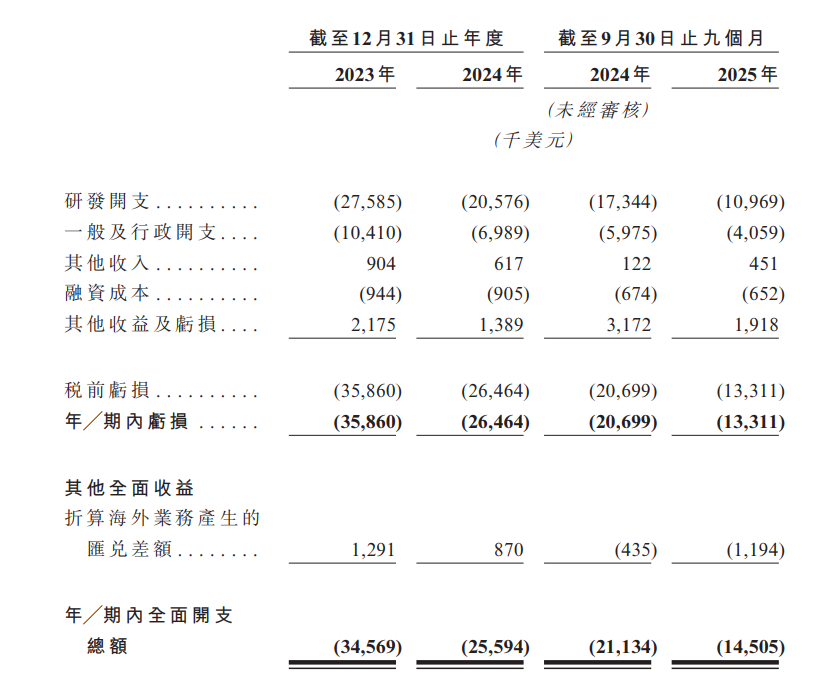
芳拓生物业绩表现
目前,芳拓生物还没有商业化产品。业绩方面,截至2023年及2024年12月31日止年度,公司期内亏损分别为3590万美元、2650万美元,2025年前九个月录得亏损1330万美元。此次港股募资拟用于两款核心产品的持续临床研发活动,以及早期管线项目的研发等。
2015年以来,美国批准了16款基因治疗药物。2025年4月1日,国内首款基因疗法才正式获批,用于中重度血友病B(先天性凝血因子IX缺乏症)成年患者的治疗,背后的公司是信念医药。由于基因疗法往往针对的是超罕见疾病,所以其价格高昂。例如Luxturna是美国及欧洲批准用于治疗RPE65介导IRD的唯一基因疗法,每次治疗的定价约为85万美元。有公开资料称,信念医药的单支价格达到9.3万元,一个成人患者完整治疗的总价超过400万元。
高昂的价格也成为影响基因疗法商业化的重要因素。芳拓生物在招股书的风险因素中提到,基因疗法属一种新型疗法,且处于相对较早的商业化阶段。考虑到与基因疗法相关的高昂研发成本、复杂的生产工艺及专业的技术要求,基因疗法产品的价格通常高于其他治疗方案。倘公司候选药物的治疗成本相对于保险公司、其他第三方付款人、医生及患者的支付意愿而言过高,产品的市场接纳度可能会受到严重限制。公司的部分候选药物也采用了操作门槛相对较高的注射方法,此举可能在商业化期间限制合资格医院或机构的数目。资质不足及合作范围受限可能令候选药物无法迅速触及广泛的患者,并进一步对其商业化及市场接纳度产生不利影响。
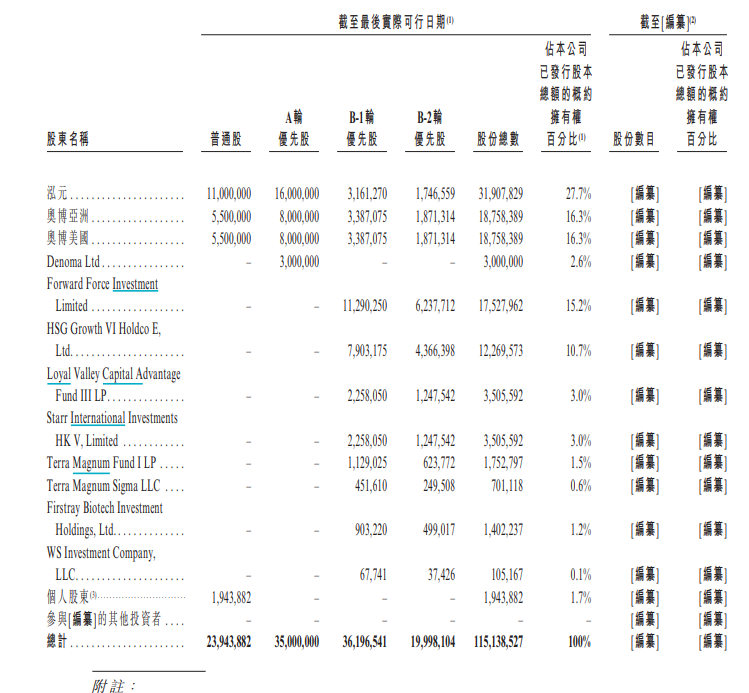
芳拓生物股东架构
股东方面,奥博资本实体及泓元为公司的创始股东。自注册成立以来,公司一直由独立于创始股东的管理团队运营。招股书显示,截至最后实际可行日期,泓元持有27.7%的股权,为最大单一股东。
芳拓生物的董事会共有9名董事组成,其中执行董事60岁的李新燕担任首席执行官兼首席医学官,也是公司的联合创始人。招股书显示,李新燕拥有5年临床实践经验,以及超10年免疫学及生物技术研发经验,并投身创新型药物研发超过20年。李新燕曾在上海泽生科技开发股份有限公司、昆药集团股份有限公司、科济药业控股有限公司全资子公司恺兴生命科技(上海)有限公司等药企工作。
